CÃĄc bà i khÃĄc
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 1 PhÆ°ÆĄng phÃĄp và kÄĐ nÄng háŧc tášp mÃīn khoa háŧc táŧą nhiÊn
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 2 NguyÊn táŧ
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 3 NguyÊn táŧ hÃģa háŧc
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 4 SÆĄ lÆ°áŧĢc bášĢng tuᚧn hoà n cÃĄc nguyÊn táŧ hÃģa háŧc
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 5 PhÃĒn táŧ - ÄÆĄn chášĨt - HáŧĢp chášĨt
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 6 Giáŧi thiáŧu váŧ liÊn kášŋt hÃģa háŧc (4 tiášŋt)
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 7 HÃģa tráŧ và cÃīng tháŧĐc hÃģa háŧc
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 8 Táŧc Äáŧ chuyáŧn Äáŧng
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 9 Äáŧ tháŧ quÃĢng ÄÆ°áŧng â tháŧi gian
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 10 Äo táŧc Äáŧ
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 11 Táŧc Äáŧ và an toà n giao thÃīng
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i Ãn tášp cháŧ§ Äáŧ 3
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 12 MÃī tášĢ sÃģng ÃĒm (3 tiášŋt)
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 13 Äáŧ to và Äáŧ cao cáŧ§a ÃĒm (3 tiášŋt)
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 14 PhášĢn xᚥ ÃĒm
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i Ãn tášp cháŧ§ Äáŧ 4
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 15 Ãnh sÃĄng, tia sÃĄng
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 16 Sáŧą phášĢn xᚥ ÃĄnh sÃĄng
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 17 ášĒnh cáŧ§a vášt tᚥo báŧi gÆ°ÆĄng phášģng
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i Ãn tášp cháŧ§ Äáŧ 5
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 18 Nam chÃĒm (2 tiášŋt)
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 19 TáŧŦ trÆ°áŧng (3 tiášŋt)
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 20 TáŧŦ trÆ°áŧng trÃĄi ÄášĨt â sáŧ dáŧĨng la bà n
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i Ãn tášp cháŧ§ Äáŧ 6
- KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 21 Nam chÃĒm Äiáŧn (1 tiášŋt)
KHTN 7 chÃĒn tráŧi sÃĄng tᚥo: TášĢi slide trÃŽnh chiášŋu bà i 6 Giáŧi thiáŧu váŧ liÊn kášŋt hÃģa háŧc (4 tiášŋt)
MášŦu giÃĄo ÃĄn powerpoint, giÃĄo ÃĄn Äiáŧn táŧ, slide trÃŽnh chiášŋu khoa háŧc táŧą nhiÊn 7 chÃĒn tráŧi sÃĄng tᚥo. Chi tiášŋt bà i 6 Giáŧi thiáŧu váŧ liÊn kášŋt hÃģa háŧc (4 tiášŋt). Bà i giášĢng nà y ÄÆ°áŧĢc thiášŋt kášŋ hášĨp dášŦn, cuáŧn hÚt. CÃĄc náŧi dung chÃnh ÄÆ°áŧĢc trÃŽnh bà y cÃī Äáŧng, dáŧ nháŧ. GiÃĄo ÃĄn dÃđng Äáŧ chiášŋu lÊn tivi, mÃĄy chiášŋu dᚥy cho háŧc sinh. TášĢi váŧ ÄÆĄn giášĢn, dáŧ dà ng
Náŧi dung giÃĄo ÃĄn










......
=> PhÃa trÊn cháŧ là máŧt phᚧn. GiÃĄo ÃĄn khi tášĢi váŧ cÃģ Äáŧ§ náŧi dung bà i háŧc
Náŧi dung chÃnh trÃŽnh bà i trong Slides
CHÃO MáŧŠNG CÃC EM ÄášūN VáŧI BÃI HáŧC HÃM NAY!
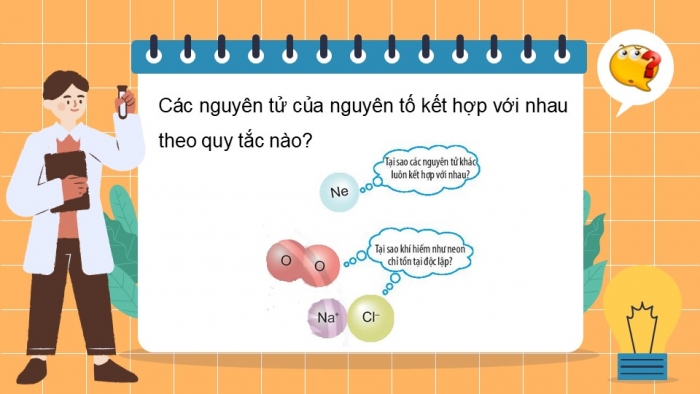
CÃĄc nguyÊn táŧ cáŧ§a nguyÊn táŧ kášŋt háŧĢp váŧi nhau theo quy tášŊc nà o?
BÃI 6: GIáŧI THIáŧU Váŧ LIÃN KášūT HÃA HáŧC
(4 Tiášŋt)
NáŧI DUNG BÃI HáŧC
Váŧ nguyÊn táŧ khà hiášŋm
LiÊn kášŋt ion
LiÊn kášŋt cáŧng hÃģa tráŧ
ChášĨt ion, chášĨt cáŧng hÃģa tráŧ
Máŧt sáŧ tÃnh chášĨt cáŧ§a chášĨt ion và chášĨt cáŧng hÃģa tráŧ
- Váŧ nguyÊn táŧ khà hiášŋm
- Váŧ nguyÊn táŧ khà hiášŋm
- HÃĢy Äáŧc tÊn cÃĄc nguyÊn táŧ thuáŧc nhÃģm khà hiášŋm?
- Sáŧ electron ngoà i cÃđng cáŧ§a máŧi nguyÊn táŧ?
- Sáŧ láŧp electron cáŧ§a máŧi nguyÊn táŧ?
TráŧŦ helium, váŧ nguyÊn táŧ cáŧ§a cÃĄc nguyÊn táŧ cÃēn lᚥi cÃģ nháŧŊng Äiáŧm giáŧng và khÃĄc nhau gÃŽ?
Giáŧng nhau: Äáŧu cÃģ 8 electron áŧ láŧp ngoà i cÃđng.
KhÃĄc nhau: Sáŧ láŧp electron khÃĄc nhau (tÄng dᚧn: 1 láŧp, 2 láŧp, 3 láŧpâĶ)
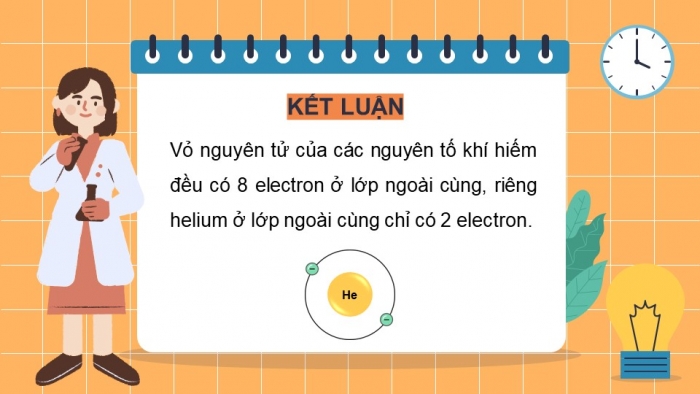
KášūT LUᚎN
Váŧ nguyÊn táŧ cáŧ§a cÃĄc nguyÊn táŧ khà hiášŋm Äáŧu cÃģ 8 electron áŧ láŧp ngoà i cÃđng, riÊng helium áŧ láŧp ngoà i cÃđng cháŧ cÃģ 2 electron.
Äáŧ cÃģ sáŧ electron áŧ láŧp ngoà i cÃđng giáŧng nguyÊn táŧ cáŧ§a nguyÊn táŧ khà hiášŋm, cÃĄc nguyÊn táŧ cáŧ§a cÃĄc nguyÊn táŧ cÃģ khuynh hÆ°áŧng nhÆ°áŧng hoáš·c nhášn hoáš·c gÃģp chung electron.
NguyÊn táŧ cáŧ§a cÃĄc nguyÊn táŧ kim loᚥi thÆ°áŧng cÃģ khuynh hÆ°áŧng nhÆ°áŧng electron.
NguyÊn táŧ cáŧ§a cÃĄc nguyÊn táŧ phi kim thÆ°áŧng cÃģ khuynh hÆ°áŧng nhášn hoáš·c gÃģp chung electron.
- LiÊn kášŋt ion
- MÃī tášĢ sáŧą tᚥo thà nh ion dÆ°ÆĄng
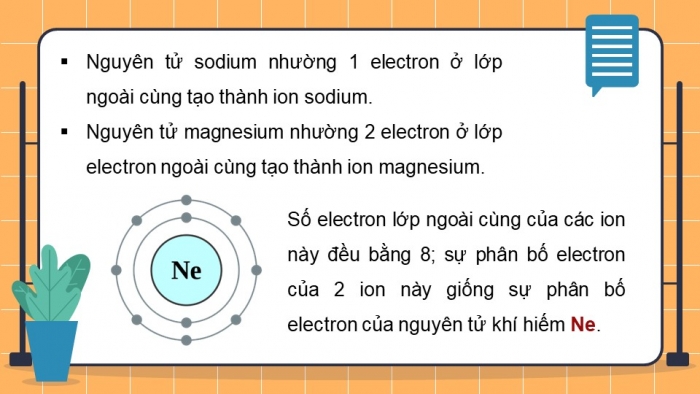
Quan sÃĄt HÃŽnh 6.2, em hÃĢy mÃī tášĢ sáŧą tᚥo thà nh ion sodium, ion magnesium.
Nhášn xÃĐt váŧ sáŧ electron láŧp ngoà i cÃđng cáŧ§a cÃĄc ion nà y và cho biášŋt sáŧą phÃĒn báŧ electron cáŧ§a 2 ion nà y giáŧng sáŧą phÃĒn báŧ electron cáŧ§a nguyÊn táŧ khà hiášŋm nà o?
- NguyÊn táŧ sodium nhÆ°áŧng 1 electron áŧ láŧp ngoà i cÃđng tᚥo thà nh ion sodium.
- NguyÊn táŧ magnesium nhÆ°áŧng 2 electron áŧ láŧp electron ngoà i cÃđng tᚥo thà nh ion
- Sáŧ electron láŧp ngoà i cÃđng cáŧ§a cÃĄc ion nà y Äáŧu bášąng 8; sáŧą phÃĒn báŧ electron cáŧ§a 2 ion nà y giáŧng sáŧą phÃĒn báŧ electron cáŧ§a nguyÊn táŧ khà hiášŋm Ne.
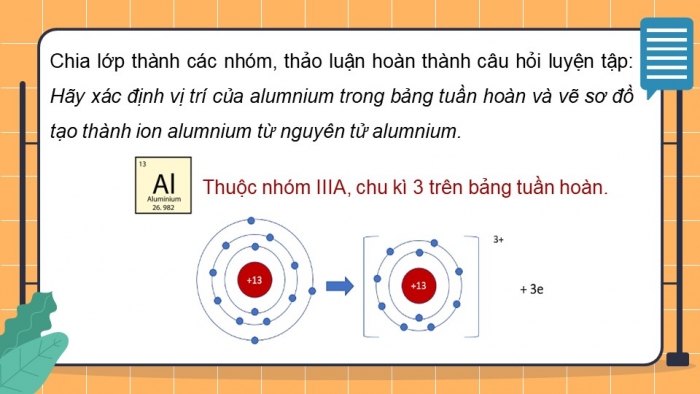
- Chia láŧp thà nh cÃĄc nhÃģm, thášĢo luášn hoà n thà nh cÃĒu háŧi luyáŧn tášp: HÃĢy xÃĄc Äáŧnh váŧ trà cáŧ§a alumnium trong bášĢng tuᚧn hoà n và váš― sÆĄ Äáŧ tᚥo thà nh ion alumnium táŧŦ nguyÊn táŧ alumnium.
- Chia láŧp thà nh cÃĄc nhÃģm, thášĢo luášn hoà n thà nh cÃĒu háŧi luyáŧn tášp: HÃĢy xÃĄc Äáŧnh váŧ trà cáŧ§a alumnium trong bášĢng tuᚧn hoà n và váš― sÆĄ Äáŧ tᚥo thà nh ion alumnium táŧŦ nguyÊn táŧ alumnium.
- Thuáŧc nhÃģm IIA, chu kÃŽ 4 trong bášĢng tuᚧn hoà n.
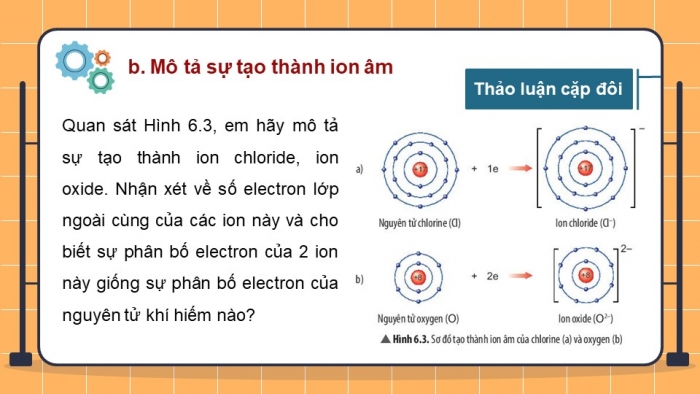
- MÃī tášĢ sáŧą tᚥo thà nh ion ÃĒm
Quan sÃĄt HÃŽnh 6.3, em hÃĢy mÃī tášĢ sáŧą tᚥo thà nh ion chloride, ion oxide. Nhášn xÃĐt váŧ sáŧ electron láŧp ngoà i cÃđng cáŧ§a cÃĄc ion nà y và cho biášŋt sáŧą phÃĒn báŧ electron cáŧ§a 2 ion nà y giáŧng sáŧą phÃĒn báŧ electron cáŧ§a nguyÊn táŧ khà hiášŋm nà o?
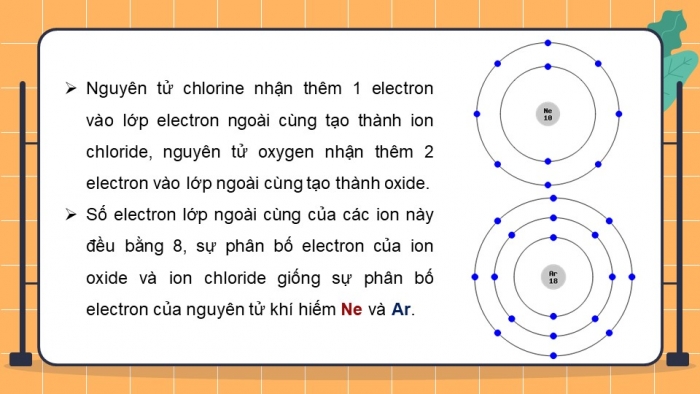
- NguyÊn táŧ chlorine nhášn thÊm 1 electron và o láŧp electron ngoà i cÃđng tᚥo thà nh ion chloride, nguyÊn táŧ oxygen nhášn thÊm 2 electron và o láŧp ngoà i cÃđng tᚥo thà nh oxide.
- Sáŧ electron láŧp ngoà i cÃđng cáŧ§a cÃĄc ion nà y Äáŧu bášąng 8, sáŧą phÃĒn báŧ electron cáŧ§a ion oxide và ion chloride giáŧng sáŧą phÃĒn báŧ electron cáŧ§a nguyÊn táŧ khà hiášŋm Ne và Ar.
Chia láŧp thà nh cÃĄc nhÃģm, tháŧąc hiáŧn nhiáŧm váŧĨ:
NhÃģm 1 + 3:
XÃĄc Äáŧnh váŧ trà cáŧ§a sunfur trong bášĢng tuᚧn hoà n và váš― sÆĄ Äáŧ tᚥo thà nh ion sunfur ( ) táŧŦ nguyÊn táŧ sunfur.
NhÃģm 2 + 4:
XÃĄc Äáŧnh váŧ trà cáŧ§a nitrogen trÊn bášĢng tuᚧn hoà n và váš― sÆĄ Äáŧ tᚥo thà nh ion nitride táŧŦ nguyÊn táŧ nitrogen.
Â
ThÃīng tin tášĢi tášĢi liáŧu
Nhášn xÃĐt
ÄÃĄnh giÃĄ trung bÃŽnh
Chi tiášŋt
Kho tà i liáŧu Khoa háŧc táŧą nhiÊn 7 chÃĒn tráŧi sÃĄng tᚥo
GiÃĄo ÃĄn láŧp 7 chÃĒn tráŧi sÃĄng tᚥo chÆ°ÆĄng trÃŽnh máŧi bášĢn chuášĐn
1. GiÃĄo ÃĄn ban táŧą nhiÊn
- GiÃĄo ÃĄn toÃĄn 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn vášt là 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn hoÃĄ háŧc 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn sinh háŧc 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn tiášŋng anh 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Khoa háŧc táŧą nhiÊn 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
2. GiÃĄo ÃĄn ban xÃĢ háŧi
- GiÃĄo ÃĄn ngáŧŊ vÄn 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn láŧch sáŧ 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn cÃīng dÃĒn 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Äáŧa là 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
3. GiÃĄo ÃĄn cÃĄc mÃīn khÃĄc
- GiÃĄo ÃĄn mÄĐ thuášt 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Ãm nhᚥc 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn cÃīng ngháŧ 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn tháŧ dáŧĨc 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn tin háŧc 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Hoᚥt Äáŧng trášĢi nghiáŧm 7 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
GiÃĄo ÃĄn khoa háŧc táŧą nhiÊn chÃĒn tráŧi sÃĄng tᚥo bášĢn chuášĐn, Äᚧy Äáŧ§
Khoa háŧc táŧą nhiÊn chÃĒn tráŧi THCS
- GiÃĄo ÃĄn Khoa háŧc táŧą nhiÊn 6 ChÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Khoa háŧc táŧą nhiÊn 7 ChÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Khoa háŧc táŧą nhiÊn 8 ChÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
- GiÃĄo ÃĄn Khoa háŧc táŧą nhiÊn 9 chÃĒn tráŧi sÃĄng tᚥo chuášĐn nhášĨt
